Vědci dokázali zpomalit stárnutí buněk a ovlivnit jejich dlouhověkost
31.7.2023 |
Molekulární biologové a bioinženýři pracující ve skupině profesora Nan Hao z Kalifornské univerzity v San Diegu odhalili některé klíčové mechanismy stárnutí a jeho možného vlivu na délku života a zdraví. V další práci využili tyto poznatky pro významné prodloužení života modelového organismu.
Délka života je dána stárnutím jednotlivých buněk. Aby vědci pochopili, zda různé buňky stárnou stejnou rychlostí a ze stejných důvodů, studovali stárnutí u pučících kvasinek Saccharomyces cerevisiae, které sloužily jako model pro zkoumání mechanismů stárnutí mitotických typů buněk, jako jsou třeba kmenové buňky. Výzkum stárnutí kvasinek se zaměřil na délku života měřenou počtem buněčných dělení před smrtí. Vědci identifikovali dvě odlišné cesty, kterými se buňky během stárnutí ubírají. Výzkum byl popsán v časopise Science.
Vědci zjistili, že izogenní buňky (buňky se stejným genetickým materiálem) divokého typu vykazují během stárnutí ve stejném prostředí dva typy fenotypových změn. Zjistili, že přibližně polovina buněk stárne postupným poklesem stability jadérka, oblasti jaderné DNA, kde se syntetizují klíčové komponenty "továren" na výrobu bílkovin (režim 1). Oproti tomu druhá polovina stárne v důsledku dysfunkce mitochondrií, buněčných jednotek produkujících energii (režim 2). Jadérka byla zvětšená a fragmentovaná ve všech buňkách stárnoucích v režimu 1, ale ne v buňkách stárnoucích v režimu 2. Mitochondrie v buňkách režimu 1 si však po celý život zachovaly normální tubulární morfologii, zatímco v buňkách režimu 2 se před smrtí buňky shlukovaly, což je v souladu s úbytkem mitochondrií pozorovaným dříve u části buněk.
Oba režimy stárnutí tedy byly spojeny s odlišnými poruchami organel: režim 1 s úbytkem jadérek a režim 2 s úbytkem mitochondrií. Buňky se na počátku života vydávají buď „cestou jádra“, nebo „cestou mitochondrií“ a po této "cestě stárnutí" jdou po celou dobu života až do zániku a smrti.
Následně vědci získali přehled o molekulárních procesech, které jsou základem jednotlivých cest stárnutí, a o souvislostech mezi nimi. To vedlo k vytvoření nového modelu stárnutí, který by mohl umožňovat manipulaci a optimalizaci procesu stárnutí.
Výstupy tohoto výzkumu naznačují možnost navrhnout genové nebo chemické terapie k přeprogramování způsobu stárnutí lidských buněk s cílem účinně oddálit lidské stárnutí a prodloužit období dobrého zdraví, známé jako „healthspan“.
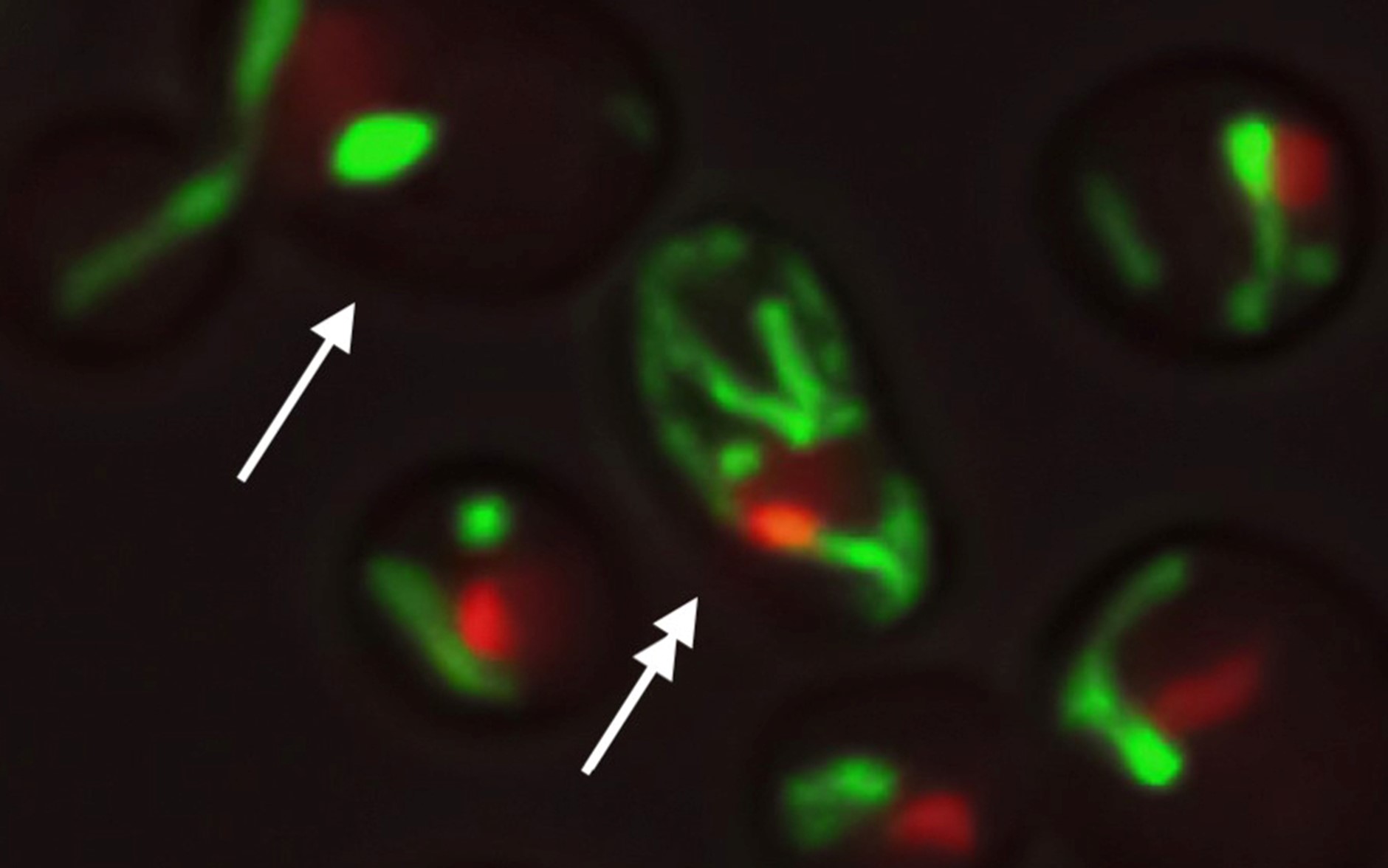
Obr.: Kvasinkové buňky se stejnou DNA ve stejném prostředí vykazují odlišnou strukturu mitochondrií (zeleně) a jádra (červeně), což může být příčinou rozdílných způsobů stárnutí. Jednoduchá a dvojitá šipka ukazují na dvě buňky s odlišnou morfologií mitochondrií a jádra.
O to se pokusili vědci ze stejné skupiny v dalším výzkumu, kdy se snažili geneticky manipulovat s těmito procesy, aby životnost buněk prodloužili. Výsledky opět publikovali v časopise Science.
Vědci vyvinuli biosyntetické "hodiny", které brání buňkám dosáhnout „normální“ úrovně poškození související se stárnutím. Prodloužili buněčnou dlouhověkost tím, že vytvořili genový oscilátor, díky kterému buňky cyklicky přechází od jednoho mechanismu stárnutí k druhému. Přepojením tohoto transkripčního přepínače do smyčky s negativní zpětnou vazbou se Zhouovi a spolupracovníkům podařilo prodloužit životnost buněk o 82 % ve srovnání s kontrolními buňkami, které stárly „za normálních podmínek“.
Nový úspěch syntetické biologie má potenciál změnit vědecké přístupy k oddálení stárnutí. Na rozdíl od četných chemických a genetických pokusů přinutit buňky k umělému stavu "mládí" poskytuje nový výzkum důkaz, že zpomalení tikání hodin stárnutí je možné aktivním zabráněním buňkám, aby se vydaly na předem určenou cestu úpadku a smrti. A genové oscilátory by mohly být univerzálním systémem, jak toho dosáhnout.
Vědci používají pro jednodušší pochopení tohoto mechanismu přirovnání s automobilem. Při normálním používání automobilu se opotřebovávají všechny jeho části – motor i převodovka současně (u reálného auta pochopitelně i další komponenty). Ale představte si auto, u kterého se při provozu opotřebovává pouze motor a převodovka ne. Po nějaké době se auto přepne do režimu s opotřebením převodovky, ale motoru se opotřebení v tomto režimu netýká. Přepínáním obou režimů by se tak mohla životnost automobilu zajímavě prodloužit.
Autoři práce sami říkají: "Naše práce představuje „proof-of-concept“, který demonstruje úspěšné použití syntetické biologie k přeprogramování procesu stárnutí buněk. Může položit základy pro navrhování syntetických genových obvodů k účinné podpoře dlouhověkosti u složitějších organismů." Tým v současné době rozšiřuje svůj výzkum na stárnutí různých typů lidských buněk, včetně kmenových buněk a neuronů.
Zdroje:
- https://www.science.org/doi/10.1126/science.aax9552
- https://www.sciencedaily.com/releases/2023/04/230427173454.htm
- https://www.science.org/doi/10.1126/science.add7631
- Genetika stárnutí: Studium genů, které ovlivňují procesy stárnutí a dlouhověkost. Hledání genetických faktorů, které mohou buď zrychlovat nebo naopak prodlužovat životní cyklus organismů.
- Telomery a telomeráza: Výzkum telomer, speciálních struktur na koncích chromozomů, a enzymu telomerázy, který je schopen prodlužovat telomery. Telomery jsou klíčové pro stabilitu chromozomů a jsou spojovány s procesem stárnutí.
- Mitochondriální dysfunkce: Studium mitochondrií, buněčných organel, které se starají o produkci energie. Akumulace poškození mitochondrií v průběhu stárnutí může hrát důležitou roli ve ztrátě buněčné funkce a energetickém deficitu.
- Oxidativní stres: Výzkum vlivu volných radikálů a oxidativního stresu na buněčné struktury a funkce. Oxidativní stres může přispět k poškození buněk a být jedním z faktorů přispívajících ke stárnutí.
- Imunitní systém: Studium imunitního systému v souvislosti se stárnutím a zhoršenou obranyschopností vůči infekcím a onemocněním.
- Epigenetika: Výzkum epigenetických změn, tedy změn ve způsobu, jakým jsou geny regulovány, v souvislosti se stárnutím a vlivem životního prostředí na genovou expresi.
- Metabolismus a výživa: Studium metabolismu a vlivu různých stravovacích vzorců a nutričních komponent na procesy stárnutí a zdraví.
- Regenerace a obnova tkání: Výzkum mechanismů regenerace tkání a jejich obnovení v souvislosti se stárnutím a zhoršenou schopností těla regenerovat se s postupujícím věkem.
- Farmakologické intervence: Hledání potenciálních léčiv nebo terapeutických látek, které by mohly ovlivnit procesy stárnutí a prodloužit zdravý životní věk.
- Kognitivní a neurologické změny: Výzkum vlivu stárnutí na mozkovou funkci a kognitivní schopnosti, a hledání způsobů, jak chránit mozek před degenerativními procesy.